新闻动态
| 免疫调节生物材料及其在慢性炎症相关疾病治疗中的应用 |
| 时间:2021-04-01 16:36 来源:未知 作者:polymer 点击: 次 |
组织修复再生与功能重建是涉及炎症微环境动态调整的复杂过程。正常生理条件下,一定限度的炎症反应对于组织修复再生及机体功能重建是必需的。其中,炎性细胞的系列行为(如募集、活化、增殖分裂与极化等)及其所产生的相应炎症因子在组织再生中起着决定性作用。然而,一旦炎症反应失控,将造成对机体组织的二次损伤,产生慢性炎症,导致组织空洞或萎缩、纤维化及瘢痕化的发生,阻碍修复再生进程的同时,可能会导致器官衰竭、重建失败甚至机体死亡。而随着对炎症微环境的深入研究及免疫调控生物材料的蓬勃发展,通过免疫调节生物材料对炎症微环境进行直接调控有助于为慢性炎性疾病带来新颖的治疗方法。近日,本课题组以免疫调节生物材料对免疫微环境的调节及其在慢性炎症相关疾病治疗中的应用为主线,受邀撰写了题为“Immunomodulatory biomaterials and their application in therapies for chronic inflammation-related diseases”的综述文章,并于2021年发表在Acta Biomaterialia期刊上(DOI: 10.1016/j.actbio.2021.01.025)。论文第一作者为Jayachandra Reddy Nakkala博士,通讯作者为高长有教授。
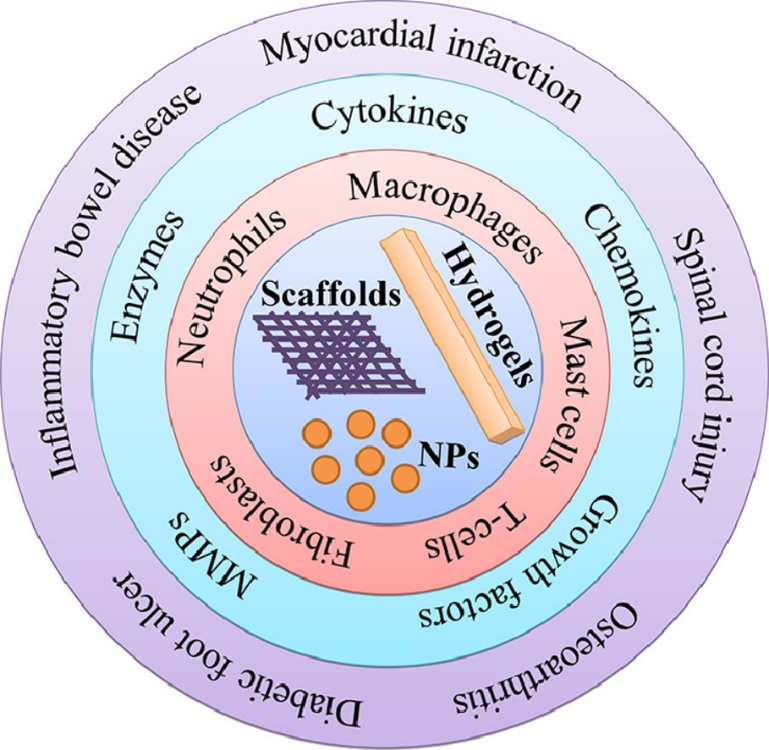
图1 利用生物材料进行炎症微环境调节并用于相应疾病模型的治疗示意图。
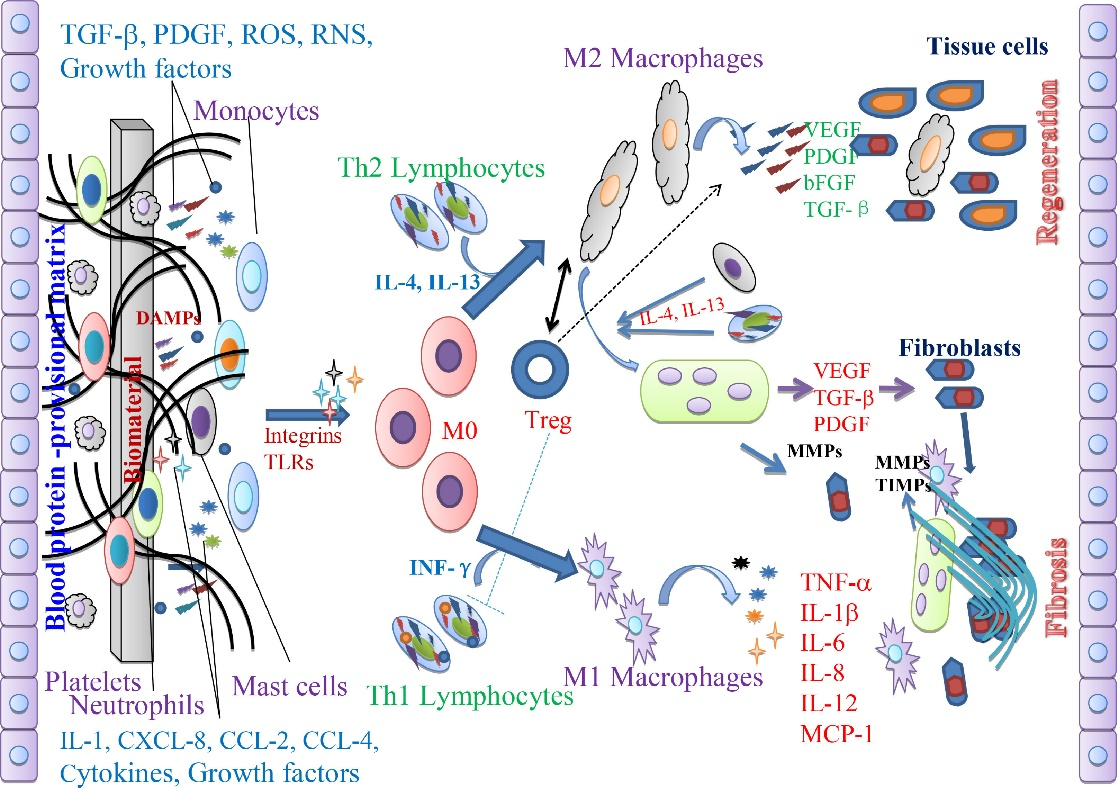
具体地,机械创伤后的组织修复再生和功能重建是涉及炎症微环境动态改变与调整的过程,其速率取决于损伤的程度,以及随后炎症反应的强度和持续时间。在急性炎症的早期阶段,募集并活化包括但不限于巨噬细胞、中性粒细胞、肥大细胞、T细胞,以及激活破骨细胞、小胶质细胞等病理部位的常驻免疫细胞,从而开始组织清创等修复工作;随后,通过将促炎表型的或静息状态下的巨噬细胞或中性粒细胞等转变成修复表型细胞,降低促炎症反应并分泌促修复性细胞因子,促进组织重塑和修复;最后阶段,炎症细胞从损伤部位消失或通过凋亡消除,以恢复组织稳态。然而,如若炎症反应过于强烈且得不到及时且有效的调控,对于机体组织存在的持续刺激可能导致慢性炎症,且通常会招致大范围的细胞凋亡、坏死或丢失,损害修复再生的进程并导致空洞、纤维化或瘢痕的形成,进而造成组织失能,并最终导致器官衰竭甚至机体死亡。
图2 炎症相关疾病过程中组织病理微环境显著改变,涉及到多种炎性免疫细胞和细胞因子。 生物材料因其优良的生物相容性和独特的生理特性而备受组织工程和再生医学领域的青睐。其中,免疫调节生物材料因其在减少炎症细胞浸润、促进炎症细胞极化及炎性生物活性因子响应消除等免疫调节过程中起着重要的作用,在组织修复和再生中的重要性日益增加。在对各种炎症相关疾病过程中病理条件的改变进行深入认识,以明确的病理靶标对生物材料的设计进行指引,进而填补免疫炎症微环境与生物材料之间的空白并在二者之间架起沟通的桥梁,能够促进组织微环境调节生物材料及相应交叉学科的发展,推动精准再生医疗的实施,从而为组织修复再生和机体功能重建提供更好的解决方案。论文对纳米粒子、水凝胶及支架等多种形式的生物材料在免疫微环境调控上的具体机理和功效进行了详尽阐述。在此基础上,重点介绍了心肌梗塞、脊髓损伤、骨关节炎、肠炎和糖尿病皮肤溃疡等多种慢性炎症相关疾病的炎症病理过程及免疫调节生物材料在对抗此类慢性炎症疾病和促进组织修复再生与功能重建中的独到作用。 该综述最后对免疫调节生物材料在慢性炎症疾病调控过程中的关键技术及问题进行了总结与展望,并结合材料学、再生医学及生物电子学等相关领域的前沿动向发展及其在组织工程中的应用进行了深入探讨。具体地,如何利用免疫调节生物材料进行快速且高效促进促炎性免疫细胞极化为促修复表型、了解生物材料与免疫细胞之间的相互作用过程中炎症微环境相应的病理改变过程成为了制约生物材料疗法的主要问题。同时,我们深刻地认识到,慢性炎性疾病的修复再生和功能重建过程,仍需要多种方式进行组合方能得到更为优异的效果。随着人们对生命健康的逐渐重视、生物电子学等交叉学科的逐渐兴起,运用含有生物材料及器件进行快速诊断同时予以有效治疗的“诊疗一体化”植入体正方兴未艾,也越发成为免疫调控生物材料的一个有前景且必然的发展方向。 稿件来源:李梓铭 |