新闻动态
| 本课题组在纳米粒子表面手性调控细胞胞吞、蛋白吸附等方面取得系列进展 |
| 时间:2017-02-20 10:40 来源:未知 作者:polymer 点击: 次 |
纳米材料因其具有的特殊性质在生物医学领域的研究发展迅速。特别地,功能化纳米颗粒在药物和基因传递、生物学成像和诊断方面有着广泛的应用。因此,研究纳米颗粒和细胞之间的相互作用机理,是作为理解纳米生物效应本质的重要前提之一。此外,纳米颗粒在细胞内降解的安全性还有待进一步研究进行阐明。本课题组在Nanotechnology杂志(IF=3.573)上发表了一篇综述,主要介绍了最近几年关于纳米颗粒的设计及其与细胞相互作用的研究进展。内容重点包括了纳米颗粒的细胞胞吞、纳米颗粒的胞内分布状态以及其降解作用与纳米毒性的相关研究。这些基本因素的提出有利于纳米颗粒-细胞相互作用的优化与设计出具有更好生物相容性的纳米颗粒,以期能够应用到生物化学等相关领域中。
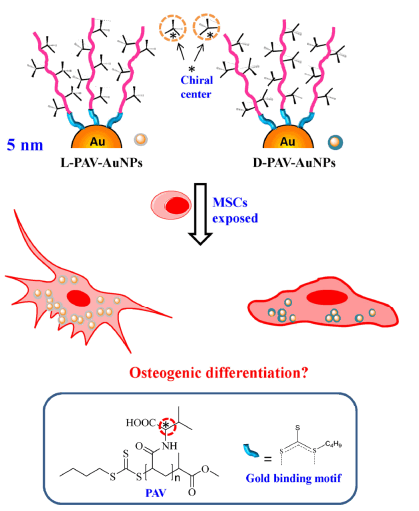
本课题组在纳米粒子与细胞作用的相关研究最新成果如下: (1)表面带有手性聚(丙烯酰-L(D)-缬氨酸)的金纳米粒子,可诱导间充质干细胞向成骨细胞分化 手性是自然界中普遍存在的现象,例如蛋白质中所有的氨基酸(除甘氨酸以外)都是左旋的,而所有的DNA和RNA中的糖类都是基于右旋的脱氧核糖核酸和核糖糖环。手性可以说是生命体最独特的生化特征之一,并在维持活细胞或生物体的正常功能中发挥了关键的作用。来自另一课题组的开创性工作已经证明了纳米涂覆基底材料的手性性质对细胞分化的影响,但是还没有人研究过纳米颗粒表面手性对干细胞的相关影响。本课题组邓君博士研究了关于聚(丙烯酰-L(D)-缬氨酸)(L(D)-PAV)锚定的金纳米粒子(AuNPs)表面分子手性性质对间充质干细胞(MSCs)分化的影响。结果表明,虽然MSCs的成骨分化不受D-PAV-AuNPs的影响,但其通过钙沉积、碱性磷酸酶(ALP)活性以及mRNA和蛋白质水平上的I型胶原和骨钙素(OCN)的表达方面证实了,MSCs的分化在L-PAV-AuNP影响下会有显著的诱导作用。L-PAV-AuNPs可以激活P38丝裂原活化蛋白激酶(MAPK)通路,并且可能由于粒子的大量内化作用会对MSCs产生机械应激作用。这些实验结果提供了一种新见解,即在纳米尺度上的表面手性会对引导MSC的分化起直接调节作用,以及这些纳米材料在再生医学领域有着潜在的应用价值。这项成果发表于Nano Research杂志上(IF: 8.893)。
图1. 表面锚定有聚(丙烯酰-L(D)-缬氨酸)的金纳米粒子对间充质干细胞分化影响的示意图
(2)表面带有聚(丙烯酰-L(D)-缬氨酸)的金纳米粒子具有增强手性作用,对细胞胞吞作用具有手性选择性
同时,纳米尺度上的手性表面对细胞胞吞的影响还未被探究过。本课题组邓君博士通过研究首次揭示了金纳米粒子(AuNPs)表面分子手性性质对细胞胞吞的调节作用。其分别在AuNPs表面上形成了单层的2-巯基乙酰-L(D)-缬氨酸(L(D)-MAV)和聚(丙烯酰-L(D)-缬氨酸)(L(D)-PAV)手性分子。无论手性如何变化,PAV-AuNPs在A549和HepG2细胞实验中的胞吞量都是MAV-AuNPs胞吞量的几倍,然而,D-PAV-AuNPs的胞吞程度要明显大于L-PAV-AuNPs。这种手性影响胞吞量的原因可能是细胞膜表面的L-磷脂更愿意与D-对映异构体进行相互作用。这项成果发表于Scientific Reports杂志上(IF: 5.228)。

图2. 手性分子(MAV和PAV)接枝到AuNPs表面,以研究手性相关性细胞胞吞作用
(3)蛋白吸附对于与手性寡聚体结合的金纳米粒子的细胞胞吞作用的影响
当纳米颗粒(NPs)遇到生物流体时,蛋白质不可避免地会吸附在其表面上以形成蛋白质的冠层。尽管其重要性被广泛认识并接受,关于NPs的表面手性对蛋白质冠层的形成和由此对细胞胞吞产生的影响仍未被探究过。因此,本课题组邓君博士通过制备得到的表面结合聚(丙烯酰-L(D)-缬氨酸)(L(D)-PAV)和聚(丙烯酰-L(D)-缬氨酸)-b-聚(2-羟乙基甲基丙烯酸酯)(L(D)-PAV-b-PHEMA)手性分子的金纳米粒子(AuNPs),研究其在含有浓缩血清的培养基中与血清蛋白、A549和HepG2癌细胞的相互作用。在富含血清的培养基中,不论纳米颗粒表面的光学活性如何,蛋白质都大量吸附到了PAV-AuNPs的表面上,同时覆盖了粒子表面的手性,使手性对细胞胞吞没有明显影响作用。因此,通过将PAV与疏水PHEMA嵌段接枝后再修饰AuNPs表面,可以明显减少蛋白质的吸附,从而稳定了手性对细胞胞吞选择性的影响作用,表明通过非特异性排斥作用和手性靶向作用的组合可以得到显著的影响结果。此项成果发表于Materials Chemistry Frontiers杂志上。

图3. L(D)-PAV和L(D)-PAV-b-PHEMA合成过程及其结合到AuNPs表面的示意图
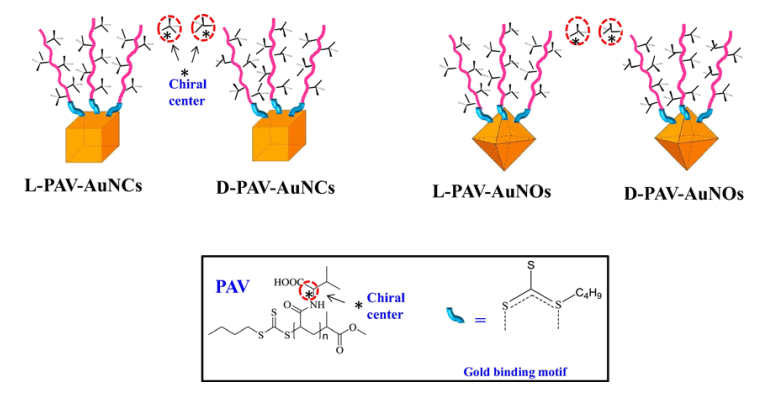
(4)具有不同表面手性和结构的金纳米粒子毒性相关研究
纳米粒子(NPs)对细胞生物学具有着深远的影响。然而,具有不同表面手性和结构的金纳米粒子(AuNPs)对细胞潜在的不利影响尚未得到阐明。在此项研究中,单层聚(丙烯酰-L(D)- 缬氨酸)(L(D)-PAV)手性分子分别锚定在金纳米立方体(AuNCs)和金纳米八面体(AuNOs)粒子的表面上。除了粒子表面不同的手性特征外,L-PAV-AuNCs和D-PAV-AuNCs以及L-PAV-AuNOs和D-PAV-AuNOs在尺寸、形态和配体密度方面具有相同的理化性质。L –PAV修饰的AuNCs和AuNOs对A549细胞的细胞毒性大于D-PAV所修饰粒子的细胞毒性,当表面手性相同时,PAV-AuNOs比PAV-AuNCs具有更大的细胞毒性,细胞毒性与细胞胞吞量呈正相关的关系,胞吞量增多,因此产生胞内活性氧(ROS)增多,从而对细胞毒性增大。此研究意义在于其制备出了不同结构和表面手性的金纳米粒子,以及探究了在纳米尺度上结构和表面手性对细胞毒性和基因毒性的影响,为药物传递、生物成像、诊断与纳米粒子的设计提供了一个新的视角。此项成果发表于Acta Biomaterialia杂志上(IF:6.008)。
 |