祝贺邓永岩同学的“3‑Bromopyruvate-Conjugated Nanoplatform Induced Pro-Death Autophagy for Enhanced Photodynamic Therapy against Hypoxic Tumor”在ACS Nano上发表,2020年的影响因子为14.588。(ACS Nano 2020, 14, 8, 9711,DOI: 10.1021/acsnano.0c01350)。
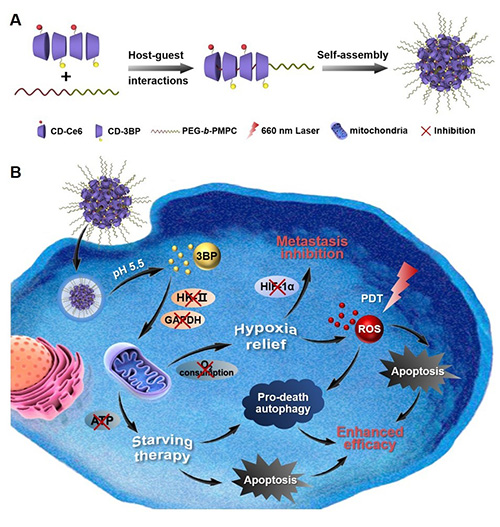
光动力学治疗(PDT)通过产生活性氧(ROS)来诱导细胞凋亡,是肿瘤治疗的有效手段。同时,ROS也是细胞自噬行为的重要诱因。PDT诱导的自噬通常被认为是一种细胞保护反应,抑制癌细胞凋亡。自噬抑制剂在一些研究中被用于增强PDT的治疗功效,但通过自噬抑制剂来完全抑制保护性细胞自噬是非常困难的。因此,如果利用“Turn enemies into friends”的策略,诱导细胞自噬过度激活,将自噬的作用从促生存逆转成促死亡,能够有效克服自噬在PDT中凋亡抑制的作用,提高PDT治疗效果。此外,乏氧是实体瘤的显著特征,乏氧相关缺氧诱导因子(HIF-1α)的上调与肿瘤转移呈现正相关。同时,乏氧环境会减弱ROS的生成,也是PDT的一大阻碍。一些研究通过增加氧气供应量来改善肿瘤乏氧,而通过抑制细胞氧气消耗的途径也有望提高乏氧肿瘤的治疗效果。
针对乏氧肿瘤光动力学治疗的主要问题,本文利用3-溴丙酮酸(3BP)作为自噬促进剂和缺氧改善剂,提高乏氧肿瘤的光动力学治疗效果。3BP能够通过下调己糖激酶(HK)-Ⅱ和甘油三磷酸脱氢酶(GAPDH)来抑制细胞糖酵解和细胞呼吸作用,减少细胞O2消耗,缓解肿瘤乏氧,增加ROS的生成;同时抑制细胞ATP生成,导致细胞饥饿诱导的过度自噬,进一步促进细胞凋亡。该团队通过pH敏感键将3BP连接在基于α-环糊精(CD)与聚乙二醇的超分子纳米平台中,共传递光敏剂二氢卟吩e6(Ce6),从3BP诱导的促死亡自噬和缺氧缓解两方面增强的光动力学治疗效果。另外,乏氧缓解有利于抑制HIF-1α因子,从而抑制肿瘤转移的发生。