祝贺叶婉莹同学的“Structure-Switchable DNA Programmed Disassembly of Nanoparticles for Smart Size Tunability and Cancer-Specific Drug Release”在ACS Appl. Mater. Interfaces上发表,2019年的影响因子为8.758。(https://dx.doi.org/10.1021/acsami.0c03957)
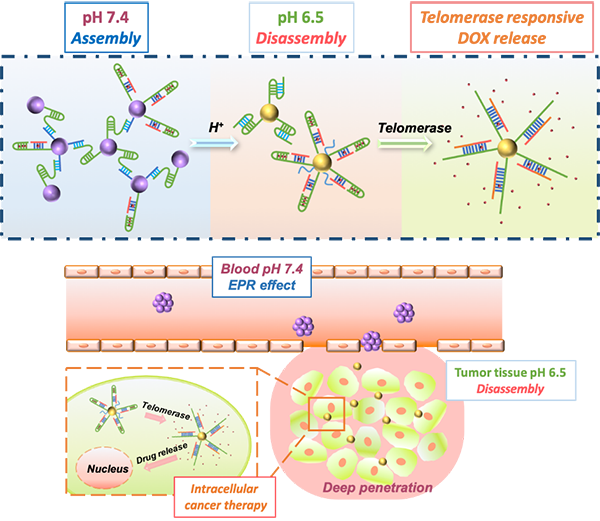
在治疗癌症的纳米药物开发中,有效改善药物向肿瘤部位的传递效率一直是研究的重点与难点。高效的药物传递不但有助于提高癌症治疗效果,更能有效避免药物毒性对正常组织器官的危害,从而减轻病人痛苦。而纳米药物自进入血液到传递至肿瘤组织的过程中,需要克服免疫系统清除、肿瘤基质屏障等重重阻碍,可谓“过五关,斩六将”,这便更需要纳米药物具备足够“智能”的响应功能,在不同传递环节中“见招拆招”。而尺寸作为纳米粒子的重要可调参数,也常被用于优化药物向肿瘤部位的传递效率。然而,随着相关研究的不断深入,人们发现具有固定尺寸的纳米粒子往往难以应对不同传递过程的需求,因而开发具有动态尺寸调控功能的新型纳米材料成为了改善纳米药物传递效率的新思路。为解决大尺寸纳米药物在肿瘤部位渗透困难与药物靶向释放的问题,课题组在前期工作中,基于DNA分子的结构转变功能设计了一种具有肿瘤组织层次与细胞层次双响应的动态解组装纳米药物载体。
我们采用pH响应性的三链DNA及其互补序列对金纳米粒子进行表面修饰,在pH 7.4的中性条件下,两种纳米粒子能够基于Watson-Crick碱基识别作用通过双链DNA形成尺寸100 nm左右的组装体,从而通过EPR效应在肿瘤部位有效富集;而在肿瘤组织pH 6.5的微酸条件下,由于碱基的质子化作用,在Hoogsteen相互作用的主导下DNA会自发转化为三链与单链的分离状态从而诱导纳米粒子发生解组装,并以30 nm左右的小尺寸获得肿瘤部位深层渗透的效果。同时,通过在纳米粒子表面修饰负载化疗药物阿霉素的发卡DNA,并以癌细胞过度表达的端粒酶作为药物释放的响应性开关,还能实现药物在癌细胞内的特异性释放。研究结果表明,该组装体能够在肿瘤组织pH诱导下实现灵敏、可逆的动态解组装,并且其动态组装与解组装行为具有优异的尺寸可调节性。体外细胞球渗透模型与动物模型也均证实该双响应药物载体能够有效提高药物在肿瘤组织处的渗透性能与传递效率,并通过癌细胞特异性的细胞内药物释放,有效降低了药物对正常细胞的细胞毒性,明显改善了药物的抑瘤效果。这一基于DNA修饰纳米粒子的双响应药物传递体系也为新型纳米药物平台的开发带来了新的可能。