仿智能微载体
仿生智能微载体的研究集中在以功能材料的设计与合成为基础的纳米生物医用材料的研究,主要研究内容为仿生智能微载体用于癌症的早期诊断和治疗,包括仿生纳米材料的设计与合成、光响应与光治疗纳米载体的制备与应用、吉西他滨键合药的设计及在胰腺癌治疗上的应用。该研究是化学、材料、高分子、药学、临床医学等多学科的交叉。
代表性论文:Small, 2016, 12, 2731-2740; Chem. Commun., 2016, 52, 582-585; 2016, 52, 3966-3969; 2015, 51, 2999-3002; 2015, 51, 17425-17438; Nanoscale, 2016, 8, 283-291; ACS Appl. Mater. Interfaces, 2016, 8, 6852-6858; J. Mater. Chem. B, 2015, 3, 3297-3305; ACS Macro Lett., 2014, 3, 679-683
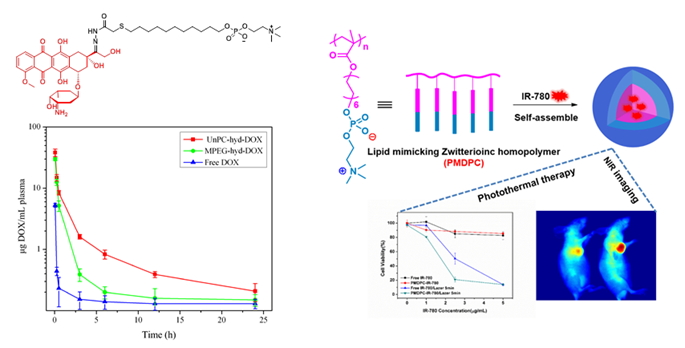
一、两性离子仿生纳米载体的设计与合成
纳米药物载体在体内传递过程中,为了实现纳米载体的生理稳定性和长效循环,最经典的做法是对纳米载体进行聚乙二醇(PEG)修饰,但PEG修饰的纳米载体在提高抗非特异性吸附的同时也降低了被肿瘤细胞有效内吞的能力,且具有加速血液清除现象。针对PEG修饰存在的诸多问题,我们创新性地通过两性离子仿生修饰构建一系列纳米药物载体,有效解决了纳米载体非特异性阻抗与细胞选择性内吞的矛盾。
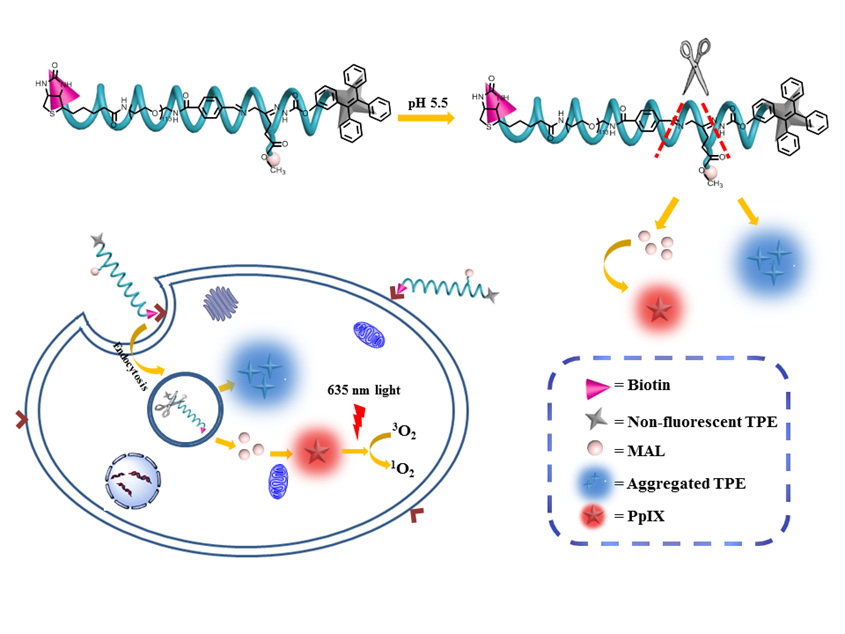
二、光响应与光治疗纳米载体的制备与应用
在药物传递过程中,如何实现细胞内药物智能释放对于提高治疗的疗效极为关键。我们利用光在量化控制上的独特优势,构筑光响应纳米载体,实现了药物释放的精确调控和量化控制。同时,我们利用光热、光动力学直接杀死肿瘤细胞,并结合主动靶向和联合治疗的方式,解决肿瘤化疗多药耐药性问题,为肿瘤治疗手段的优化提供新策略。
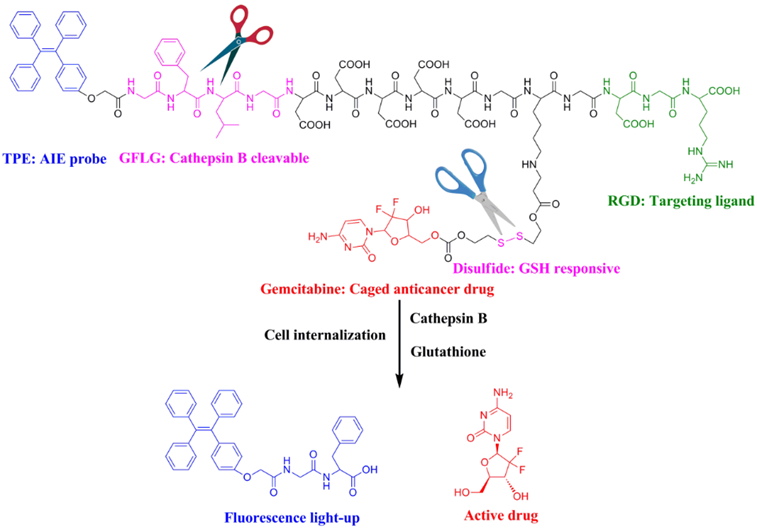
三、吉西他滨键合药的设计
胰腺癌是一种恶性程度很高,诊断和治疗都很困难的恶性肿瘤,五年生存率低于5%,化疗常常成为胰腺癌患者的唯一选择。吉西他滨是临床上胰腺癌治疗的一线化疗药物,但其在体内很容易被脱氨酶降解而失去药理活性。针对这一临床问题,我们通过药物输送技术的改变,设计肿瘤微环境响应的多功能吉西他滨键合药,不仅实现了胰腺癌治疗的诊疗一体化,还大大提高了化疗的疗效。